Katedra Genetyki i Podstaw Hodowli Zwierząt
Wydział Medycyny Weterynaryjnej i Nauk o Zwierzętach
Uniwersytet Przyrodniczy w Poznaniu
NAUKA → PRAKTYCE
Poniżej zaprezentowane są wyniki naszych badań naukowych, które mogą być wykorzystane w praktyce hodowlanej lub weterynaryjnej.
Zainteresowanych zapraszamy do współpracy.

Frymartynizm – ważna przyczyna niepłodności jałówek
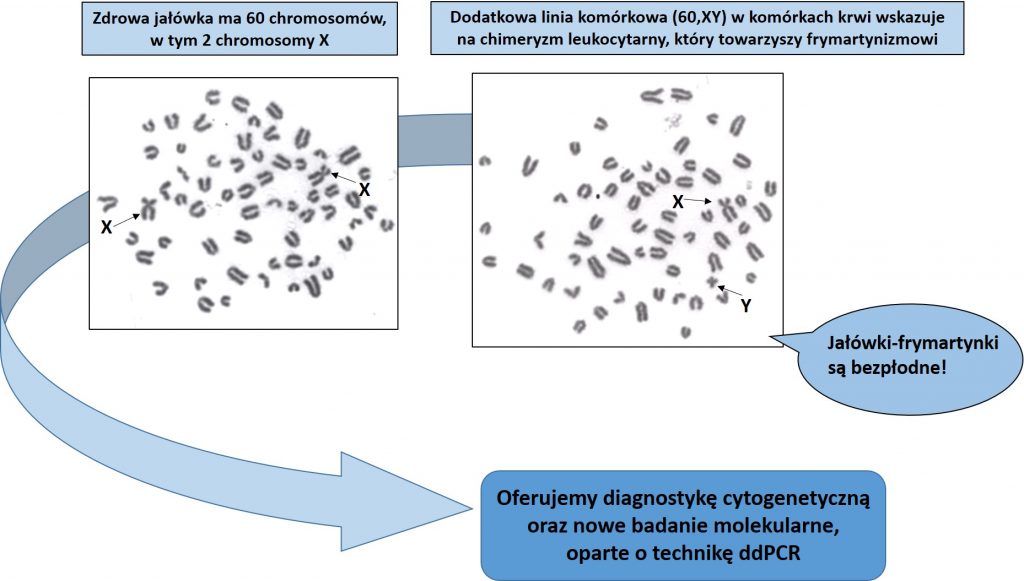
Frymartynizm jest najczęstszym, niedziedzicznym zaburzeniem rozwoju płci, prowadzącym do bezpłodności. Zaburzenie to występuje u jałówek, które rozwijały się życiu płodowym wraz z płodem męskim. W przypadku ponad 90% takich ciąż powstają połączenia naczyniowe (anastomozy) między łożyskami obu płodów, czego efektem jest wspólne krążenie krwi podczas ciąży. Powoduje to transport czynników męskich, produkowanych przez jądra płodu męskiego, do płodu żeńskiego i zaburzenie rozwoju płci osobników żeńskich. Jałówki taki maja niedorozwinięty układ rozrodczy (macica, pochwa), ich gonady często maja strukturę jądra lub jajniko-jądra, a zewnętrzne narządy płciowe mogą mieć cechy męskie (tzw. wirylizacja) (Libera i Szczerbal, 2019). Buhajki pochodzących z takich ciąż mają normalną płodność i nie obserwuje się u ich zaburzeń rozwoju płci. Jałówki-frymartynki mogą również pochodzić z porodów pojedynczych. Sytuacja taka może zaistnieć wtedy, gdy płód męski obumrze podczas ciąży. Oznacza to, że poród pojedynczy jałówki nie gwarantuje, że nie jest ona frymartynką. Ma to szczególne znaczenie w związku z rosnąca frekwencją ciąż bliźniaczych w wysoko wydajnych populacjach bydła holsztyńsko-fryzyjskiego (Szczerbal i wsp., 2014).
Wspólny obieg krwi skutkuje również wymianą komórek szpiku kostnego, co manifestuje się obecnością dwóch linii komórkowych (tylko w komórkach krwi) – jednej z własnym układem chromosomów płci i drugiej z zestawem chromosomów płci bliźniaczego płodu. Układ taki określany jest terminem „chimeryzm leukocytarny XX/XY”. Chimeryzm nie jest przyczyną zaburzeń rozwoju płci, ale wskazuje, że doszło do anastomoz między płodami różnej płci.
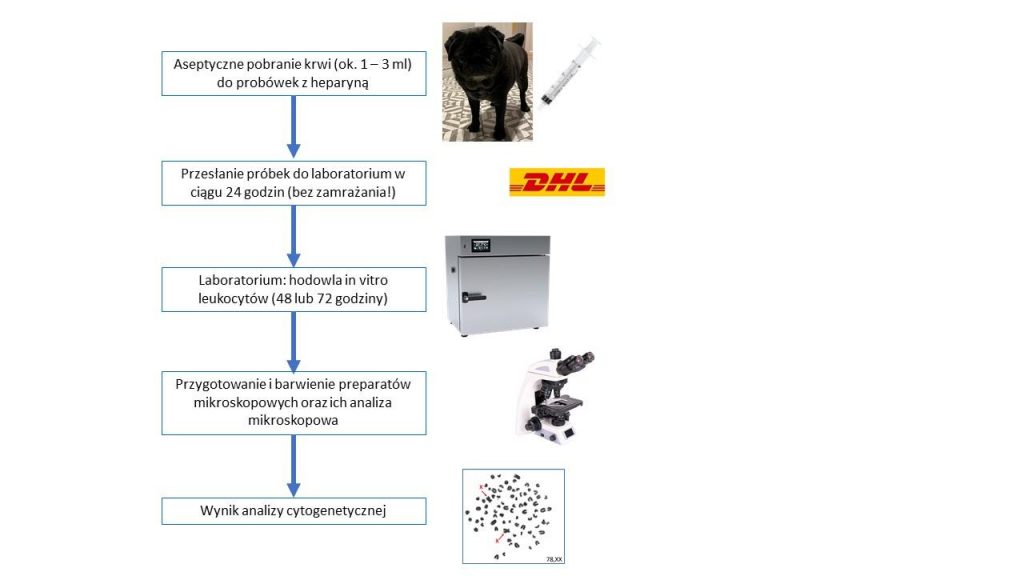
Diagnostyka frymartynizmu prowadzona jest zazwyczaj w oparciu o analizę zestawu chromosomów płci w leukocytach krwi hodowanych w warunkach laboratoryjnych. Jest to metoda bardzo wiarygodna, ale ma istotne ograniczenie. Krew pobrana od jałówki powinna być dostarczona do laboratorium w ciągu 24 godz. i powinna być niezwłocznie wykorzystana do założenia hodowli komórek leukocytów. Tę niedogodność, jaką jest ścisły reżim czasowy, można przezwyciężyć poprzez wykonanie analizy DNA wyizolowanego z komórek krwi i zastosowaniu techniki ddPCR, która umożliwia ustalenie liczby kopii chromosomów płci. U jałówki wolnej od chimeryzmu wykrywane są 2 kopie chromosmu X i brak kopii chromosomu Y. Jeśli jałówka jest frymarytnka, to stwierdza się u niej więcej kopii chromosomu X niż chromosomu Y. W przypadku układu chromosomów XY obserwuje się taka samą liczbę kopii chromosomu X i Y. Wykorzystanie techniki ddPCR do diagnostyki frymarytnizmu opisaliśmy jako pierwsi na świecie (Szczerbal i wsp., 2019).
Więcej o naszych badaniach na ten temat można przeczytać w dwóch publikacjach:
Libera K., Szczerbal I. (2019), Frymartynizm u bydla – opis przypadku, Życie weterynaryjne, 94(6): 433-436. https://www.vetpol.org.pl/dmdocuments/ZW-06-2019-08.pdf
Szczerbal I., Kociucka B., Nowacka-Woszuk J., Lach Z., Jaskowski J.M., Switonski M. (2014). A high incidence of leukocyte chimerism (60,XX/60,XY) in single born heifers culled due to underdevelopment of internal reproductive tracts. Czech Journal of Animal Sciences 59: 445–449.
https://www.agriculturejournals.cz/publicFiles/136531.pdf
Szczerbal I., Nowacka-Woszuk J., Albarella S., Switonski M. (2019). Technical note: Droplet digital PCR (ddPCR) as a new molecular method for a simple and reliable diagnosis of freemartinism in cattle. Journal of Dairy Science 102: 10100- 10104. https://www.journalofdairyscience.org/article/S0022-0302(19)30736-2/fulltext
(opracowali I.Szczerbal i M.Świtoński)

Zaburzenia rozwoju płci świń
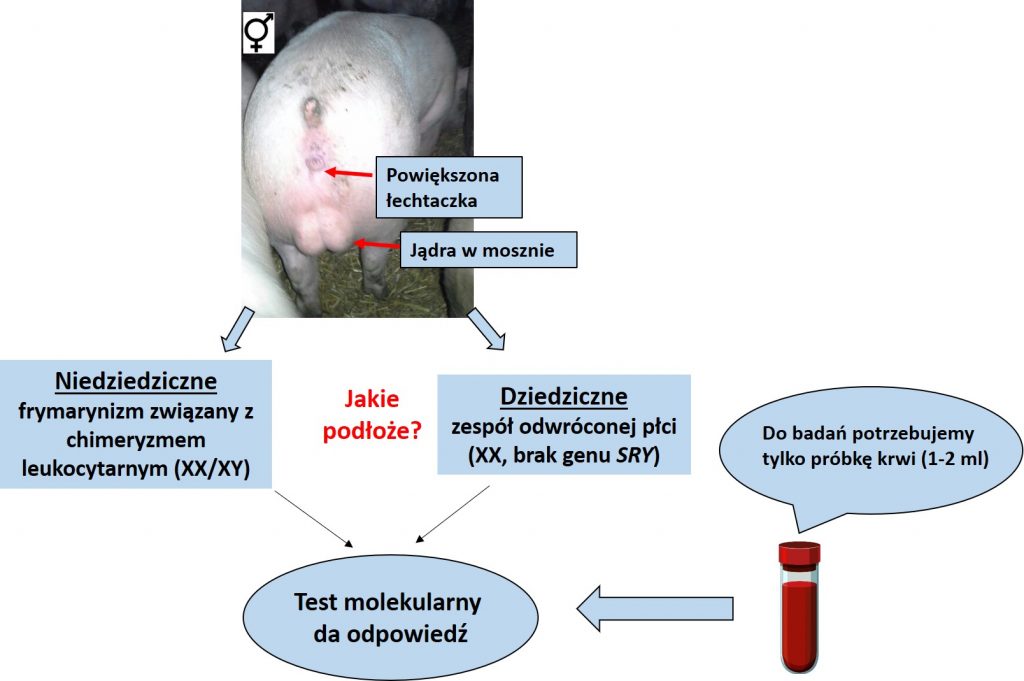
Zaburzenia rozwoju płci występują w wybranych populacjach świń nawet z częstością ok. 0,5%. Najczęściej stwierdzaną nieprawidłowością jest dziedziczny zespół odwróconej płci, chrakteryzujący się obecnością jąder lub jajniko-jader u loszek z żeńskim zestawem chromosomów płci (XX) oraz brakiem genu SRY (Switonski i wsp., 2002). Loszki takie mają zazwyczaj powiększoną łechtaczkę oraz gonady w mosznie. Niekiedy jednak gonady są niezstąpione, co powoduje, że zwierzęta takie nie podlegają kastracji, a obecność jąder negatywnie wpływa na jakość tuszy (tzw. odór knurzy). Wada ta ma charakter dziedziczny, choć jej podłoże molekularne jest słabo rozpoznane. Przypuszcza się, że może ona mieć związek ze zmianami sekwencji DNA (polimorfizm) w regionie obejmującym gen SOX9, które wywołują jego nieuprawnioną ekspresję u samic, co w konsekwencji prowadzi do rozwoju w życiu płodowym jąder lub jajniko-jader (Stachowiak i wsp., 2017).
W ostatnim czasie nasze badania pokazały, że istotną przyczyną zaburzeń rozwoju płci świń może być także niedziedziczny frymartynizm, który manifestuje się podobnymi zmianami układu płciowego jak w przypadku opisanego powyżej zespołu odwrócenia płci (Szczerbal i wsp., 2019). Zaburzenie to jest wywołane powstaniem połączeń naczyniowych (anastomozy) między łożyskami płodów różnej płci, czego efektem jest wspólne krążenie krwi podczas ciąży. Połączenia takie umożliwia dotarcie do płodu żeńskiego czynników produkowanych przez wcześniej rozwijające się jądra, co zakłóca prawidłowy rozwój żeńskiego układu płciowego. Powstanie anastomoz manifestuje się obecnością dwóch linii komórek krwi – własnej (XX) i płodu (XY), z którym jest połączony anastomozami łożyskowymi. Dzieje się tak dlatego, bo migracji poprzez anastomozy podlegają również komórki szpiku kostnego.
Odróżnienie dziedzicznego zespołu odwrócenia płci od niedziedzicznego frymartynizmu wymaga przeprowadzenia analiz diagnostycznych. Klasyczna analiza cytogenetyczna obejmuje określenie układów chromosomów płci w leukocytach. Podejście to jest dość kłopotliwe do wykonania, bowiem krew pobrana od zwierzęcia powinna być dostarczona do laboratorium w ciągu 24 godz. i niezwłocznie powinna być przygotowana hodowla leukocytów w warunkach in vitro. Nasze najnowsze badania pokazały, że określenie liczby kopii chromosomów X i Y można przeprowadzić szybko i wiarygodnie poprzez analizę molekularną DNA wyizolowanego z komórek krewi, z wykorzystaniem techniki ddPCR (Szczerbal i wsp., 2019).
Więcej o naszych badaniach na ten temat można przeczytać w publikacjach:
Switonski M., Jackowiak H., Godynicki S., Klukowska J., Borsiak K., Urbaniak K. (2002). Familial occurrence of pig intersexes (38,XX; SRY-negative) on a commercial fattening farm. Animal Reproduction Science 69: 117-124.
https://www.sciencedirect.com/science/article/pii/S0378432001001683
Stachowiak M., Szczerbal I., Nowacka-Woszuk J., Jackowiak H., Sledzinski P., Iskrzak P., Dzimira S., Switonski M. (2017). Polymorphisms in the SOX9 region and testicular disorder of sex development (38,XX; SRY-negative) in pigs. Livestock Science, 203: 48-53.
https://www.sciencedirect.com/science/article/pii/S1871141317301981
Szczerbal I, Nowacka-Woszuk J, Dzimira S, Matuszczyk A, Iskrzak P, Switonski M (2019). Elevated incidence of freemartinism in pigs detected by droplet digital PCR and cytogenetic techniques. Livestock Science 219: 52-56.
https://www.sciencedirect.com/science/article/pii/S1871141318307066
(opracowali I.Szczerbal i M.Świtoński)
Monosomia chromosomu X
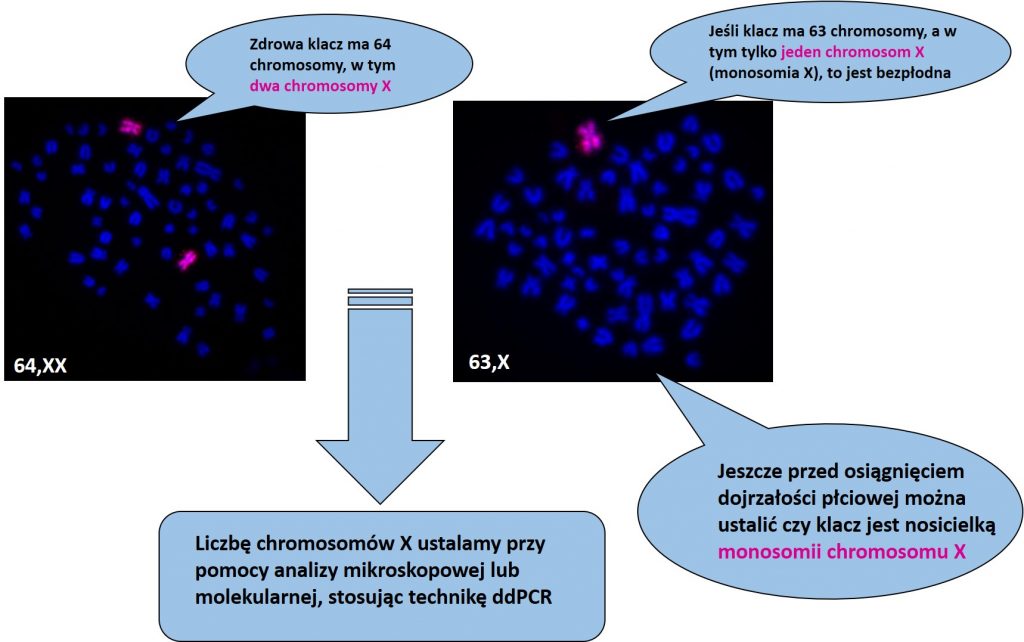
Najczęstszą wadą genetyczną związaną z rozrodem koni jest monosomia chromosomu X (brak jednego chromosomu X), która występuje u klaczy różnych ras. Prowadzi ona do powstania nieaktywnych jajników, braku cykli płciowych i trwałej bezpłodności. Wada ta może wystąpić w tzw. postaci czystej (obecność jednej linii komórkowej z brakiem chromosomu X) lub mozaikowej (obecność dwóch lub więcej linii komórkowych różniących się liczba chromosomów X, np. X/XX). Niekiedy częstość linii monosomicznej jest niska, co jednak nie ma związku ze stopniem obniżenia płodności (Wieczorek i wsp., 2002). Podkreślić należy, że monosomia X nie jest wadą dziedziczną, a jej powstanie wynika z nieprawidłowej segregacji chromosomów płci podczas gametogenezy u matki lub ojca takiej klaczy.
Klasyczna diagnostyka nieprawidłowości chromosomowych opiera się na analizie mikroskopowej preparatów uzyskanych z hodowanych w warunkach in vitro leukocytów krwi. Technika ta wymaga spełnienia dość rygorystycznych rygorów czasowych, bowiem krew po pobraniu winna być dostarczona do laboratorium w okresie 24 godzin, a następnie konieczne jest niezwłoczne przygotowanie hodowli komórkowej. Również analiza mikroskopowa jest wymagającym etapem, bowiem identyfikacja chromosomów X wymaga zastosowania techniki prążkowego barwienia chromosomów lub hybrydyzacji chromosomów znajdujących się na preparacie mikroskopowym ze znakowaną sonda molekularną rozpoznającą chromosom X.
Nasze najnowsze badania pokazały, że ustalenie liczby kopii chromosomu X może być przeprowadzone szybko i wiarygodnie poprzez analizę molekularną DNA wyizolowanego z komórek krwi a także z cebulek włosowych czy komórek nabłonkowych, z wykorzystaniem techniki ddPCR (Szczerbal i wsp. , 2019).
Więcej o naszych badaniach na ten temat można przeczytać w publikacjach:
Wieczorek M., Switonski M., Yang F. (2001). A low-level X chromosome mosaicism in mares, detected by chromosome painting. Journal of Applied Genetics 42 (2): 205-209.
https://pubmed.ncbi.nlm.nih.gov/14564053/
Szczerbal I., Nowacka-Woszuk J., Kopp-Kuhlman C., Mackowski M., Switonski M. (2020). Application of droplet digital PCR in diagnosing of X monosomy in mares. Equine Veterinary Journal 52: 627-631.
https://beva.onlinelibrary.wiley.com/doi/10.1111/evj.13214
Analiza linii żeńskich koników polskich na podstawie mitochondrialnego DNA
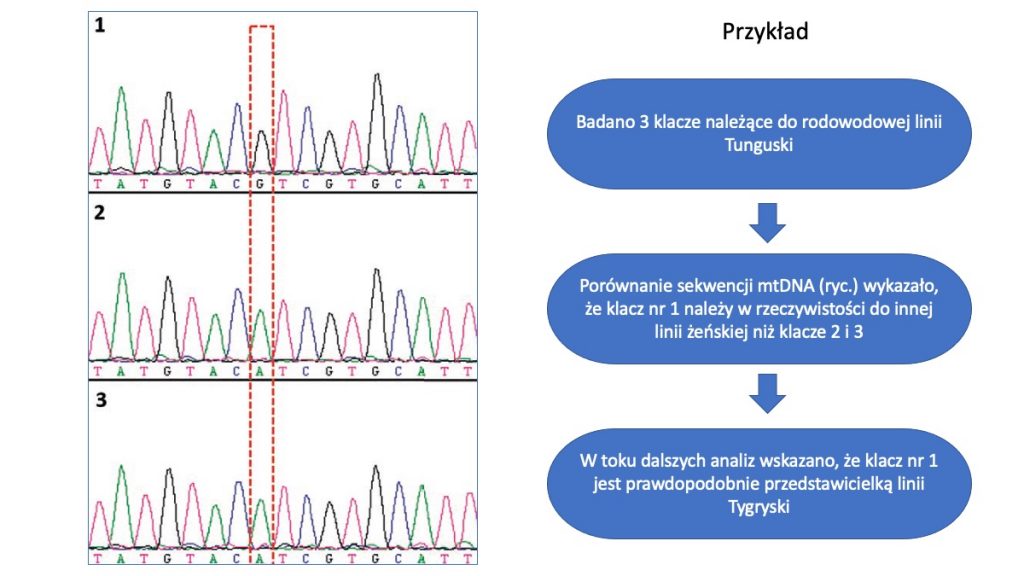
Ciągłe monitorowanie różnorodności genetycznej jest bardzo ważne w przypadku ras zwierząt objętych ochroną zachowawczą. W programie ochrony zasobów genetycznych koników polskich szczególny nacisk kładzie się na zachowanie i zrównoważony rozwój wszystkich aktywnych obecnie w hodowli 16 linii żeńskich.
Bardzo skutecznym narzędziem do monitorowania różnorodności genetycznej linii matecznych, wspomagającym tradycyjne metody oparte o dane rodowodowe, jest analiza sekwencji mitochodndrialnego DNA (mtDNA). Dzięki dziedziczeniu wyłącznie „po matce” badanie mtDNA pozwala na precyzyjne wskazanie czy dana grupa zwierząt rzeczywiście należy do tej samej linii żeńskiej (Mantaj i wsp., 2020). A jak wskazują nasze badania opublikowane w roku 2017 nie musi tak być, gdyż jedynie 5 rodowodowych linii matecznych koników polskich jest genetycznie „czystych” – tzn. posiada jeden, charakterystyczny wariant (tzw. haplotyp) mtDNA. W pozostałych liniach obserwujemy mniejsze lub większe zróżnicowanie które oznacza, że w przeszłości doszło do pomyłek w zapisach rodowodowych zwierząt i część z żyjących obecnie klaczy nie reprezentuje faktycznie linii, do których są przypisane w księgach hodowlanych (Cieslak i wsp., 2017).
Badanie sekwencji mtDNA wyizolowanego z krwi lub cebulek włosowych koni bardzo często pomaga hodowcom koników polskich w ustaleniu przynależności danej klaczy do rzeczywistej linii żeńskiej oraz w określeniu realnego poziomu matecznej różnorodności genetycznej stada. Więcej informacji na temat wykorzystania badań mtDNA w analizach filogenetycznych koni jest dostępnych w naszych publikacjach.
- Cieslak J., Wodas L., Borowska A., Cothran E.G., Khanshour A.M., Mackowski M. (2017). Characterization of the Polish Primitive Horse (Konik) maternal lines using mitochondrial D-loop sequence variation. PeerJ, 5: e3714
https://peerj.com/articles/3714/
- Mantaj W., Maćkowski M., Cieślak J. (2020). Mitochondrialny DNA a różnorodność genetyczna koni. Hodowca i Jeździec, 66(3): 34-35
https://www.hij.com.pl/produkt/hodowca-i-jezdziec-66/
Ustalenie genotypu w locus G warunkującym siwienie koni
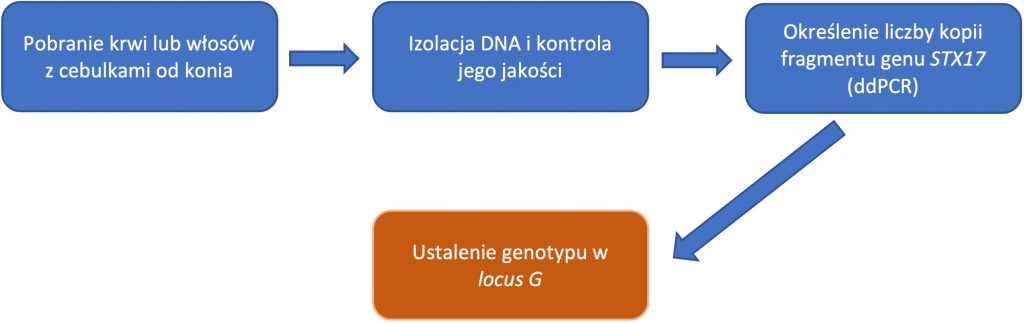
Siwienie koni wraz z wiekiem jest związane z mutacją genu syntaksyny-17 (STX17). Mutacja ta jest ważna zarówno z punktu widzenia hodowlanego jak i weterynaryjnego. Wykazano bowiem, że w zależności od genotypu w locus G (ang. Grey) konie siwieją szybciej bądź wolniej. Ponadto siwe konie o genotypie homozygotycznym GG mają większą predyspozycję do występowania agresywnych form nowotworu skóry (czerniaka) niż zwierzęta posiadające genotyp heterozygotyczny Gg. Ze względu na fakt, że mutacja genu STX17 dziedziczy się w sposób dominujący, wiedza na temat genotypu w locus G pozwala hodowcy odpowiedzieć na pytanie: czy każdy potomek danej siwej klaczy bądź ogiera również będzie siwy, czy też niekoniecznie? Jest to ważne zwłaszcza w rasach koni, w których ten typ umaszczenia jest szczególnie pożądany.
Niestety ze względu na molekularny charakter wspomnianego wariantu, będącego powieleniem (multiplikacją) rozległego fragmentu genu STX17, laboratoryjne określenie genotypu konia w „genie siwienia” nie jest zadaniem łatwym. W naszych najnowszych badaniach (Nowacka-Woszuk i wsp., 2021) wykazaliśmy, że bardzo przydatnym narzędziem molekularnym do tego typu analiz jest technika emulsyjnego (ddPCR), która pozwala na precyzyjne określenie liczby kopii fragmentu odpowiadającego za siwienie koni. Bazując na DNA wyizolowanym z krwi lub cebulek włosowych siwego konia możemy więc stwierdzić, czy posiada on w swoim genotypie jedną czy dwie kopie dominującego allelu G. Więcej o naszych badaniach można przeczytać w poniższej publikacji, a przebieg samego badania został przedstawiony na schemacie.
- Nowacka-Woszuk J., Mackowski M., Stefaniuk-Szmukier M., Cieslak J. (2021 – online early). The equine graying with age mutation of the STX17 gene: A copy number study using droplet digital PCR reveals a new pattern. Animal Genetics
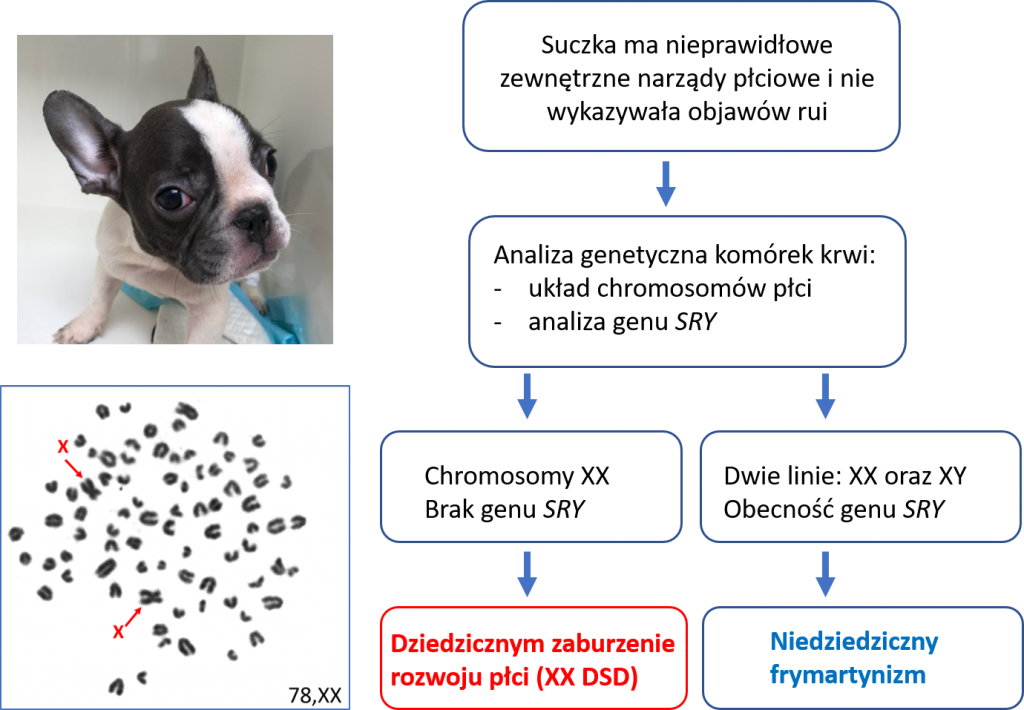
Dziedziczne zaburzenia rozwoju płci samic psa
Wrodzone wady rozwojowe układu rozrodczego opisywane są obecnie w literaturze naukowej symbolem DSD (ang. disorder of sex development). Mogą być one wywołane nieprawidłowościami chromosomowymi, mutacjami genowymi oraz czynnikami pozagenetycznymi. Wśród wad o prawdopodobnym monogenowym modelu dziedziczenia (zależnym od wariantów jednego genu), najczęstsza polega na wystąpieniu męskich cech w układzie rozrodczym genetycznych samic (układ chromosomów płci XX). Podłoże genetyczne tej wady nie zostało dotąd w pełni wyjaśnione, jednak nasze badania wskazują, że w niektórych rasach (np. mops) polimorfizm zmiennej liczby kopii (CNV – copy number variation) w regionie poprzedzającym gen SOX9 jest związany z tą wadą. Opisaliśmy także pojedynczy przypadek duplikacji całego genu SOX9 u suczki rasy American Bully (Nowacka-Woszuk i wsp. 2019). Wadę tę dotąd zdiagnozowaliśmy u 45 genetycznych samic (XX), reprezentujących 23 rasy Uwzględniając dane z literatury światowej liczba ras, w których wystąpiły takie przypadki przekracza 40. Uwagę zwraca znacząca liczba takich przypadków wśród buldogów francuskich (Szczerbal i wsp. 2019).
Pełna diagnoza tej wady u genetycznych samic opiera się o 4 kryteria: (1) zewnętrzne narządy płciowe posiadają cechy męskie (tzw. wirylizacja), (2) prawidłowy, żeński zestaw chromosomów płci (XX), (3) brak genu SRY, odpowiedzialnego z ukierunkowanie rozwoju płodowego w kierunku męskim i (4) wystąpienie jąder lub jajniko-jąder. W praktyce weterynaryjno-hodowlanej decyzje o wykonaniu badań genetycznych podejmuje się po stwierdzeniu u samicy nieprawidłowo wykształconych zewnętrznych narządów płciowych. Podkreślić należy, że pojawienie się cech męskich u samic może być także spowodowane inną przyczyną, np. fuzją naczyń krwionośnych łożysk płodów różnej płci co prowadzi do tzw. frymartynizmu. Zaburzenie to nie jest dziedziczne a jego diagnoza opiera się o wykrycie dwóch linii komórkowych w leukocytach krwi, własnej (XX) oraz płodu męskiego (XY).
Badania prowadzone sa w ramach projektu NCN pt: Kompleksowa charakterystyka regionów kandydujących w genomie psa dla monogenowych zaburzeń rozwoju płci, oparta o sekwencjonowanie nowej generacji (NGS) i cyfrowy emulsyjny PCR (ddPCR) , Nr 2016/23/B/NZ9/03424, którego kierownikiem jest prof. Marek Świtoński.Badania prowadzone sa w ramach projektu NCN pt: Kompleksowa charakterystyka regionów kandydujących w genomie psa dla monogenowych zaburzeń rozwoju płci, oparta o sekwencjonowanie nowej generacji (NGS) i cyfrowy emulsyjny PCR (ddPCR) , Nr 2016/23/B/NZ9/03424, którego kierownikiem jest prof. Marek Świtoński.
Więcej o badaniach można znaleźć w naszych publikacjach:
Szczerbal I, Nowacka-Woszuk J., Nizanski W., Dzimira S., Ligocka Z., Jastrzebska A., Kabala B., Biernacik M., Przadka P., Switonski M (2019). Disorders of sex development are an emerging problem in French Bulldogs: A description of six new cases and a review of the literature. Sexual Development 13:205-211.
https://www.karger.com/Article/Abstract/506582
Nowacka-Woszuk J., Szczerbal I., Stachowiak M., Szydlowski M., Nizanski W., Dzimira S., Maslak A., Payan-Carreira R., Wydooghe E., Nowak T., Switonski M. (2019). Association between polymorphisms in the SOX9 region and canine disorder of sex development (78,XX; SRY-negative) revisited in a multibreed case-control study. PLoS One 14(6): e0218565.
https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0218565
Marcinkowska-Swojak M., Szczerbal I., Pausch H., Nowacka-Woszuk J., Flisikowski K., Dzimira S., Nizanski W., Payan-Carreira R., Fries R., Kozlowski P., Switonski M. (2015). Copy number variation in the region harboring SOX9 gene in dogs with testicular/ovotesticular disorder of sex development (78,XX; SRY-negative). Scientific Reports 5: 14696.
https://www.nature.com/articles/srep14696
Szczerbal I., Nowacka-Woszuk J., Nizanski W., Salamon S., Ochota M., Dzimira S., Atamaniuk W., Switonski M. (2014). A case of leucocyte chimerism (78,XX/78,XY) in a dog with a disorder of sexual development. Reproduction in Domestic Animals 49, e31–e34.
Genetyczna predyspozycja labradorów do otyłości
Otyłość jest poważną chorobą ludzi, a także psów. Badaniom genetycznym tej jednostki u ludzi poświęcono wiele badań. Okazało się, że w nielicznych przypadkach (<5% pacjentów z masywną otyłością) ma ona podłoże monogenowe, czyli uwarunkowane mutacją jednego genu (najczęściej jest to gen MC4R). Natomiast zdecydowana większość przypadków (>90%) ma złożone uwarunkowanie, co oznacza wpływ nieznanej, dużej liczby genów oraz czynników pozagenetycznych (żywienie, aktywność ruchowa itp.). Efektem badań prowadzonych przez różne zespoły badawcze na świecie, które łącznie objęły kilkaset tysięcy pacjentów, jest identyfikacja kilkuset polimorfizmów DNA związanych z ryzykiem pojawienia się otyłości. Polimorfizmy te wykryto m.in. w genach FTO, MC4R i POMC.
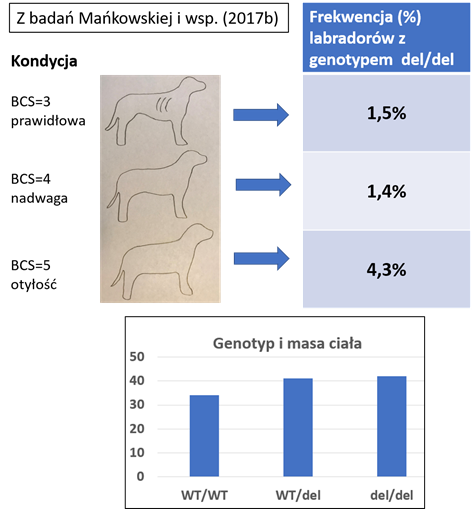
Badania otyłości psów mają znacznie krótszą i skromniejszą historię. Ocenę stopnia akumulacji tkanki tłuszczowej ocenia się u psów przy pomocy kilkustopniowej, subiektywnej skali (BCS – body condition score). Najczęściej stosowana jest skala 5-stopniowa, gdzie BCS=3 oznacza idealną kondycję, BCS=4 nadwagę, a BCS=5 otyłość. Wartości 1 i 2 oznaczają odpowiednio wychudzenie i niedowagę. Wiadomo, że problem otyłości w większym stopniu dotyka niektóre rasy – np. labrador retriever, którą najczęściej obejmowano badaniami genetycznymi. Początkowo analizy dotyczyły genów, których warianty polimorficzne wykazały związek z otyłością człowieka. Okazało się jednak, że polimorfizmy dwóch głównych genów kandydujących (FTO i MC4R) nie mają związku z ryzykiem otyłości (Grzemski i wsp., 2019; Mankowska i wsp., 2017a). Z kolei polimorfizm genu TNF wskazywał na taka zależność (Mankowska i wsp., 2016).
Przełomem w poszukiwaniu markera genetycznego związanego z otyłością labradorów były badania genu POMC. Autorzy brytyjscy wykryli 14-nukleotydową delecję, która ma istotny wpływ na apetyt i wynikająca z tego nadmierną akumulację tkanki tłuszczowej (Raffan i wsp., 2016. A Deletion in the canine POMC gene Is associated with weight and appetite in obesity-prone Labrador Retriever dogs. Cell Metabolism 23: 893-900). Psy posiadające oba allele z delecją (układ homozygotyczny ze względu na delecję) były o ok. 4 kg cięższe niż psy o przeciwstawnym genotypie homozygotycznym. Kiedy ukazała się ta praca, to byliśmy w trakcie badania innych genów również w grupie labradorów, o czym wspomniano powyżej. Oczywiście zdecydowaliśmy się sprawdzić, czy w populacji polskich labradorów występuje ta mutacja i czy jej efekt jest taki sam jak w badaniach brytyjskich. Nasze badania udzieliły pozytywnej odpowiedzi na oba pytania, a oszacowany wpływ na masę ciała był prawie 2-krotnie większy niż w badaniach brytyjskich (Mankowska i wsp., 2017b oraz schemat).
Z przedstawionych powyżej badań wynika, że w przypadku labradorów zidentyfikowano silny marker (mutacja genu POMC) odpowiedzialny za zwiększone ryzyko rozwoju otyłości. Z kolei polimorfizm genu TNF można uznać za obiecujący marker, którego związek z otyłością labradorów powinien być jeszcze potwierdzony w badaniach na innej grupie labradorów.
Więcej o naszych badaniach na ten temat można przeczytać w publikacjach:
Grzemski A., Stachowiak M., Flisikowski K., Mankowska M., Krzeminska P., Gogulski M., Aleksiewicz R., Szydlowski M., Switonski M., Nowacka-Woszuk J. (2019). FTO and IRX3 genes are not promising markers for obesity in Labrador retriever dogs. Annals of Animal Science 19: 343–357.
https://content.sciendo.com/view/journals/aoas/19/2/article-p343.xml
Mankowska M., Stachowiak M., Graczyk A., Ciazynska P., Gogulski M., Nizanski W., Switonski M. (2016). Sequence analysis of three canine adipokine genes revealed an association between TNF polymorphism and obesity in Labrador dogs. Animal Genetics 47: 245-249.
https://onlinelibrary.wiley.com/doi/abs/10.1111/age.12390
Mankowska M, Nowacka-Woszuk J, Graczyk A, Ciazynska P, Stachowiak M, Switonski M. (2017a). Polymorphism and methylation of the MC4R gene in obese and non-obese dogs. Molecular Biology Reports 44: 333-339.
https://link.springer.com/article/10.1007/s11033-017-4114-3
Mankowska M., Krzeminska P., Graczyk M., Switonski M. (2017b). Confirmation that a deletion in the POMC gene is associated with body weight of Labrador Retriever dogs. Research in Veterinary Science 112: 116-118.
https://www.sciencedirect.com/science/article/abs/pii/S0034528816304829
Nieprawidłowości chromosomowe przyczyną zaburzeń rozwoju płci i niepłodności psów
Nieprawidłowości chromosomów płci są ważną przyczyną zaburzeń rozwoju płci i wynikających z tego problemów z płodnością. Brak chromosomu X (monosomia X) u samic lub dodatkowy chromosom X (zespół XXY) u samców odpowiadają za zahamowanie rozwoju gonad, czego skutkiem jest zatrzymanie procesu produkcji gamet i bezpłodność. Inne aneuploidie (XXX lub XYY) wywołują obniżenie płodności. Dobrze znanym zaburzeniem rozwoju płci jest frymartynizm, dość często występujący u jałówek pochodzących z ciąż różnopłciowych. Wada ta jest spowodowana połączeniem naczyń krwionośnych łożysk płodów różnopłciowych, za pośrednictwem których czynniki odpowiedzialne za rozwój płci męskiej docierają do płodu żeńskiego i powodują nieprawidłowy rozwój układu rozrodczego oraz bezpłodność. Markerem tej nieprawidłowości jest obecność dwóch linii komórkowych (XX oraz XY) w komórkach krwi, określana jako chimeryzmu leukocytarnego XX/XY. Ważną grupą nieprawidłowości chromosomowych są dziedziczne mutacje strukturalne, takie jak translokacje wzajemne. Jeśli dotyczą one autosomów, to nie wywołują zaburzeń rozwoju płci, ale powodują znaczne obniżenie płodności. Z kolei translokacje między chromosomem X i autosomem wywołują bezpłodność samców i obniżoną płodność samic. W przypadku samców translokacje między chromosomem X i autosomem, czy chromosomem X i Y wywołują bezpłodność.
Wiedza o nieprawidłowościach chromosomowych psa nie jest zbyt zaawansowana. Jednym z powodów tego stanu są trudności związane z analizą cytogenetyczną, wynikającą z dużej liczby chromosomów (2n=78) i jednolitą morfologią wszystkich autosomów. Z drugiej strony identyfikacja chromosomów płci, dzięki ich odróżniającej się morfologii, jest łatwa. W naszej Katedrze prowadzimy badania cytogenetyczne psów od wielu lat. Pokazały one, że bezpłodność, często związana z zaburzeniami rozwoju płci, jest niejednokrotnie wywołana nieprawidłowościami w układzie chromosomów płci. Opisaliśmy przypadki monosomii i trisomii chromosomów płci, translokacji X-autosom oraz chimeryzmu leukocytarnego (XX/XY). Zidentyfikowaliśmy również przypadki translokacji Robertsona (fuzje centryczne), które w zasadzie nie wpływają na obniżenie płodności. Wyniki naszych badań zaprezentowaliśmy w wielu specjalistycznych czasopismach naukowych o światowym zasięgu, takich jak: Animal Reproduction Science, Reproduction in Domestic Animals, Sexual Development, Journal of Heredity, Animals itd.
Zasygnalizowane powyżej nasze osiągnięcia upoważniają nas do stwierdzenia, że w diagnostyce cytogenetycznej psów mamy pozycję lidera w wymiarze międzynarodowym. Pokazaliśmy również, że specjalistyczne badania cytogenetyczne są ważnym testem umożliwiającym kompleksową diagnostykę psów z zaburzeniami rozwoju płci lub obniżoną płodnością. W efekcie coraz częściej kontaktują się z nami lekarze weterynarii w sprawie wykonania analizy cytogenetycznej i molekularnej psów z nieprawidłowo rozwiniętymi cechami płciowymi lub zaburzeniami płodności.
Więcej informacji o naszych najnowszych badaniach można znaleźć w publikacjach:
Szczerbal I., Switonski M. (2021). Clinical Cytogenetics of the Dog: A Review. Animals 11, 947.
DOI: 10.3390/ani11040947
Szczerbal I., Nizanski W., Dzimira S., Nowacka-Woszuka J., Stachecka J. Biezynski J., Ligocka Z., Jagodka D., Fabian-Kurzok H., Switonski M. (2021). Chromosome abnormalities in dogs with disorders of sex development (DSD). Animal Reproduction Science 230, 106771.
DOI: 10.1016/j.anireprosci.2021.106771
Schemat procedury diagnostyki cytogenetycznej
Opracowali: I. Szczerbal i M.Świtoński
Nieprawidłowości chromosomów płci
Prawidłowa diploidalna liczba chromosomów kota wynosi 38. Kotki mają układ chromosomów 38,XX a kocury 38,XY. Podobnie jak u człowieka, także u kotów może dochodzić do zaburzeń liczby i struktury chromosomów płci, które skutkują m.in. wadami wrodzonymi układu rozrodczego, które prowadzą do bezpłodności. Wśród nich wyróżnić można monosomię chromosomu X – 37,X (odpowiednik zespołu Turnera człowieka – 45,X), która powoduje niedorozwój jajników oraz bezpłodność. Kotki z taką mutacją mogą być mniejszych rozmiarów i nie wykazują objawów rui. Z kolei u kocurów może wystąpić trisomia chromosomów płci – 39,XXY (odpowiednik zespołu Klinefeltera człowieka – 47,XXY). Mutacja ta zaburza rozwój jąder, które nie produkują plemników. Co ciekawe, kocury takie mogą mieć umaszczenie szylkretowe, które jest typowe dla kotek, które są heterozygotami pod względem położonego w chromosomie X genu rudego umaszczenia (Oo).
W naszym zespole poza przedstawionymi powyżej mutacjami liczbowymi, zidentyfikowaliśmy także rzadkie mutacje strukturalne chromosomów, takie jak translokacja kluczowego genu męskości SRY z chromosomu Y na chromosom X (XXSRY), co skutkowało odwróceniem płci i maskulinizacją fenotypu u chromosomowych samic. Taka mutacja u ludzi odpowiada za powstanie zespołu De La Chapelle. Innym przykładem naszych badań było wykrycie u kota z niedorozwiniętymi męskim zewnętrznymi nadrządami płciowymi oraz z macicą dwóch nieprawidłowych linii komórkowych – jednej z monosomią chromosomu X i drugą z nieprawidłowym chromosomem Y, który miał strukturę chromosomu pierścieniowego – 37,X/38,X,r(Y). Znane są również przypadki chimeryzmu leukocytarnego (38,XX/38,XY), wskazujące na zaburzenie określane terminem frymartynizm, które wywołuje bezpłodność kotek.
Przedstawione powyżej przykłady wskazują, że nieprawidłowości chromosomowe mogą stanowić istotną przyczynę zaburzeń rozwoju płci kotów. Dlatego koty z nieprawidłowo wykształconymi zewnętrznymi narządami płciowymi, nietypowym dla danej płci umaszczeniem czy wykazujące dziwne zachowanie warto poddać badaniom genetycznym, a przede wszystkim ocenie prawidłowości zestawu chromosomowego. Oferujemy takie badania, które mogą dać odpowiedź czy obserwowane zaburzenia mają podłoże genetyczne, a w tym czy mają charakter dziedziczy.
Więcej o badaniach na ten temat można przeczytać w naszych publikacjach:
Szczerbal I. , Stachowiak M., Dzimira S., Sliwa K., Switonski M. (2015). The first case of 38,XX (SRY-positive) disorder of sex development in a cat. Molecular Cytogenetics 8: 22.
https://molecularcytogenetics.biomedcentral.com/articles/10.1186/s13039-015-0128-5
Szczerbal I, Nizanski W, Dzimira S, Nowacka-Woszuk J, Ochota M, Switonski M. (2015). X monosomy in a Virilized Female Cat. Reproduction in Domestic Animals 50: 344-348.
https://onlinelibrary.wiley.com/doi/10.1111/rda.12483
Szczerbal I., Stachowiak M., Nowacka-Woszuk J., Dzimira S., Szczepanska K. , Switonski M. (2017). Disorder of sex development in a cat with chromosome mosaicism 37,X/38,X,r(Y). Reproduction in Domestic Animals 52: 914-917.
https://onlinelibrary.wiley.com/doi/abs/10.1111/rda.12968
Szczerbal I, Krzeminska P, Dzimira S, Tamminen T., Saari S, Nizanski W, Gogulski M, Nowacka-Woszuk J, Switonski M (2018 ). Disorders of sex development in cats with different complements of sex chromosomes. Reproduction in Domestic Animals 53: 1317-1322.
https://onlinelibrary.wiley.com/doi/abs/10.1111/rda.13263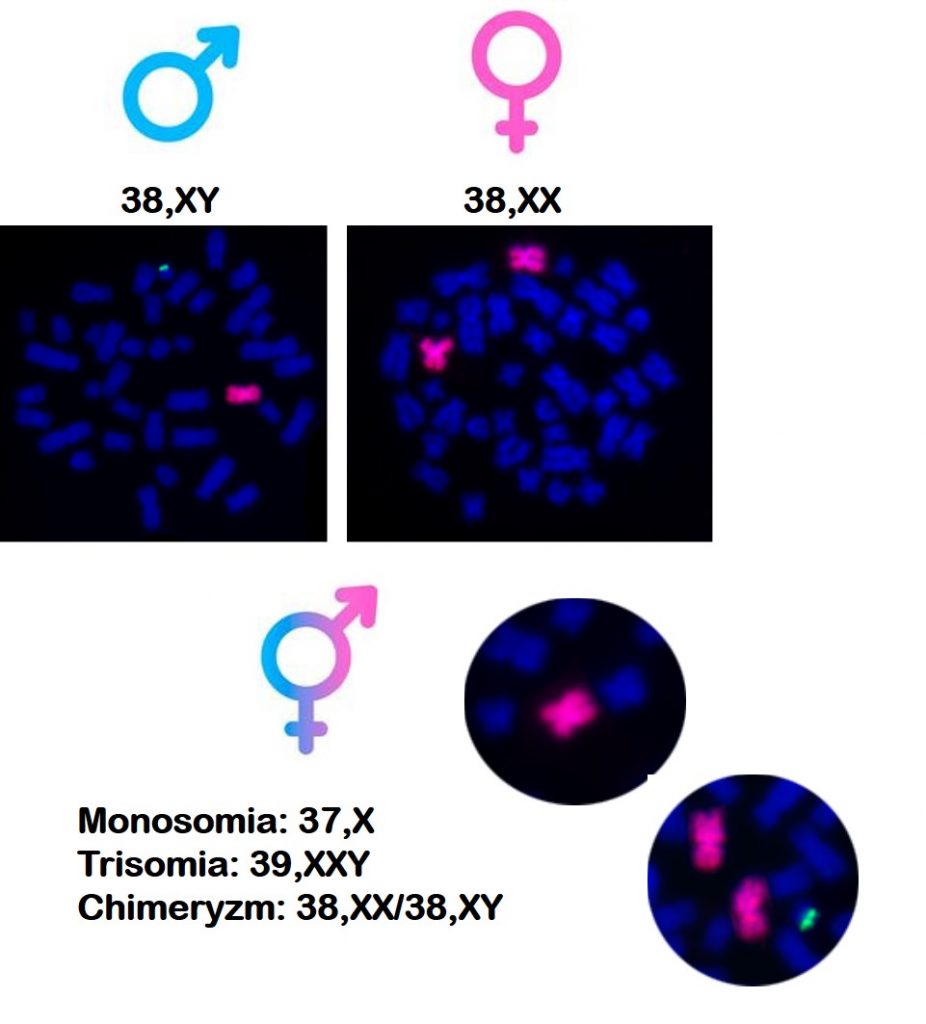 (opracowali I.Szczerbal i M.Świtoński)
(opracowali I.Szczerbal i M.Świtoński)