Organizatorzy warsztatów:
-
Katedra Ekologii i Ochrony Środowiska UWM; ul. Żołnierska 14; 10-561 Olsztyn
-
Katedra Zoologii Bezkręgowców i Limnologii US; ul. Wąska 13; 71-415 Szczecin
-
Polskie Towarzystwo Entomologiczne; ul. Dąbrowskiego 159; 60-594 Poznań
Sponsor warsztatów:
|
|
Naskalne chróściki
Los płata nam w życiu najrozmaitsze figle. Nigdy nie przepadałem za botaniką
systematyczną a egza-min z tego przedmiotu wspominam najgorzej ze wszystkich
jakie zdawałem na studiach. Jakie wielkie było więc moje rozgoryczenie,
gdy dowiedziałem się, że w tym roku muszę prowadzić ćwiczenia z... botaniki.
Nie pozostało mi nic innego, tylko jak najlepiej się do tego przygotować.
Wzdychając nad książką i przeklinając swój los, w tekście poświęconemu
porostom natknąłem się na znajomo brzmiącą nazwę: chróściki. Ku swojej
radości odkryłem, że istnieje rodzaj porostów o nazwie chróścik (Stereocaulon)!
Myślę, że jest to fakt godny odnotowania dla każdego, nieuświadomionego
dotąd trichopterologa.
Chróściki to porosty naziemne lub naskalne. Według klucza Fałtynowicza
rodzaj ten nie jest trudny do rozpoznania. Jeżeli spotkamy na ziemi krzaczkowaty
porost, którego plecha będzie miała szary kolor (nie czarny ani brunatny!),
a podecja (wyrostki plechy wtórnej, a więc to co z reguły widzimy, bo
plecha pierwotna bardzo szybko zanika) nie będą w środku puste tylko wypełnione
miąższem, to istnieje uzasadnione podejrzenie, że jest tochróścik. Podecja
chróścików mogą być pojedyncze, ale z reguły są rozgałęzione. Powierzchnia
plechy chróścików pokryta jest brodawkami, łuseczkami lub wyrostkami (fyllokadiami),
które pełnią funkcje asymilacyjne i są ważną cechą taksonomiczną.
W Polsce znamy 12 gatunków chróścików, z czego większość występuje w górach.
Na niżu chróściki rosną na miejscach piaszczystych i widnych, w murawach
napiaskowych i prześwietlonych borach sosnowych, czasem na kamieniach
i głazach.
Osobiście nigdy nie widziałem chróścika a informacje o nich zaczerpnąłem
z książki Wiesława Fałtynowicza - "Wykorzystanie porostów do oceny
zanieczyszczenia powietrza". Odtąd będę jednak zwracał baczniejszą
uwagę na porosty w poszukiwaniu chróścika. A może ktoś z czytelników widział
chróściki i mógłby napisać na ten temat bardziej "osobiście"?
Lech Pietrzak
Trichoptera - chruściki Polski
Najbardziej aktualny spis gatunków chruścików, których obecność
w Polsce została udokumentowana
(opracował: Stanisław Czachorowski, stan na kwiecień 2002)
Spis został opracowany na podstawie pracy Szczęsnego (1991), poprawiony, uzupełniony i zaktualizowany.
Do tej pory pewnie udokumentowano obecność w Polsce 268 gatunków, 4 kolejne oznaczono niepewnie (tylko larwa lub stare dane), 14 kolejnych jako wątpliwe.
Jak uporządkowane zostały dane
Każdy gatunek opisany został wg schematu:
|
Gatunek
|
wykaz Szczęsnego (1991)
|
Tomaszewski (1965) - synonimy
|
W drugiej linii zapisane są podgatunki i uwagi.
[N Czachorowski 1995 ] - gatunek nowy w stosunku do listy Szczęsnego,
opublikowany w 1995r
Rząd: Trichoptera Kirby, 1813 - chruściki
=> wykaz gatunków <=
(uwaga plik ma ponad 210KB)
Ocena błędu - wstęp do dyskusji
Stanisław Czachorowski
Celem warsztatów jest wstępne "przyjrzenie się" jak pracujemy w terenie i skąd się biorą ewentualne różnice w wynikach: czy z różnic w biocenozach, czy też z różnic w metodach badań. W ten sposób rozpoczynamy pogłębiona dyskusję nad tym co tak naprawdę decyduje o wielkości błędu i do jakiego poziomu możliwe jest wiarygodne porównywanie wyników z różnych badań. Naszym celem jest wypracowanie standardowych metod badań entomofauny wodnej, a w szerszym sensie badań faunistycznych.
-
Cel badań. W jakim stopniu cel badań (np. inwentaryzacja, badania ekologiczne, badania jakościowe, ilościowe itp.) określa możliwość wykorzystania wyników do opracowań o innym charakterze? A zatem w jakim stopniu dane z prac ekologicznych można wykorzystywać w badaniach faunistycznych i na odwrót. Naszym celem jest poznanie zróżnicowania gatunkowego w krajobrazie pojeziernym. Na ile w naszych badaniach cel badań wpływa na metody zbioru materiału? Czy też metody wynikają z charakteru grupy - ważki, chruściki, muchówki, chrząszcze wodne?
- Okres badań. W badaniach o charakterze faunistycznym często mówimy o konieczności 2-3 sezonów. Ile sezonów wegetacyjnych powinny trwać badania o charakterze faunistycznym dla określenia składu gatunkowego i struktury dominacji? Ile razy w roku powinien być pobierany materiał (uwzględniając specyfikę danej grupy), w jakich okresach? Czy możliwe jest pobranie prób jednorazowo, a jeśli tak, to na jakich warunkach (teoretycznie w każdym okresie gatunek jest obecny, bo albo w stadium jaja, larwy, poczwarki, albo imagines, śladów żerowania itp. - ale czy jest możliwe odnalezienie i poprawne zidentyfikowanie?).
- Wybór stanowisk. Ile powinno być stanowisk, jakie uwzględniać typu zbiorników, ile stanowisk w poszczególnych typach siedlisk, tak aby wiarygodnie określić faunę danego terenu (np. parku krajobrazowego, krajobrazu ekologicznego, użytku ekologicznego itp.)? Czy powinny być to duże stanowiska (zróżnicowane siedliskowo) czy też małe? Co rozumieć pod nazwą "stanowi-sko", jak duże obszarowo powinno być stanowisko?
- Opis stanowiska. Jak opisujemy stanowisko i pojedynczą próbę. Jakie cechy uznajemy za ważne, jak prowadzimy dokumentację? Czy możliwa byłaby jakaś standaryzacja?
- Pobieranie prób 1. Jakie stadia rozwojowe powinny być uwzględnione w badaniach faunistycznych. Czy możliwe jest odławianie tylko imagines lub tylko larw? Z czego wynikają i jak duże są różnice w badaniach "larwalnych" i "imaginalnych". Czy istnieje szansa znalezienia jakiegoś przelicznika umożliwiającego porównywanie obrazu fauny "larwalnej i "imaginalnej"?
- Pobieranie prób 2. Jakich przyrządów używamy do poboru prób, w jaki sposób pobieramy próbę: z jakiej powierzchni, jak długo "machamy" czerpakiem itp. Jakie są różnice w technice początkującego badacza i doświadczonego faunisty, jaki wpływ ma rutyna? Na czym mogą polegać różnice w próbie pobranej przez ważkarza, chruścikarza lub chrząszczarza (czy behawior badanej grupy narzuca inne sposoby pobierania materiału) czy też "ogólnego-hydrobiologa"?
- Wybieranie materiału. W jaki sposób przebieramy materiał (na miejscu, w pracowni), jakich przyrządów używamy, ile czasu poświęcamy jednej próbie? Czy i kiedy uzupełniamy materiał dodatkowymi próbami? W jaki sposób konserwujemy (czy może mięć to wpływ na możliwości oznaczenia?) i przechowujemy zbiory.
- Oznaczanie. Czy jednakowo dokładnie oznaczamy próby "małe" i próby "duże". Czy zmęczenie może mieć jakieś znaczenie i w jakich przypadkach?
- Bazy danych. Jak archiwizujemy dane i oznacz-nia? Jakich programów używamy, wg jakiego klucza wpisujemy dane (spróbujemy się zastanowić, czy jest możliwa jakaś standaryzacja).
- Zestawienie statystyczne. Jakich metod używamy, a jakie mogą okazać się najwłaściwsze.? Co wynika z poniższych charakterystyk, do jakiego materiału i badań faunistycznych się nadają, dla jakich nie: udział procentowy, dominacja, klasy domiancji, frekwencja, wskaźniki różnorodności, wskaźniki naturalności, inne wskaźniki czy indeksy? Jak porównujemy i za pomocą jakich algorytmów czy programów fauny różnych stanowisk, zbiorników, okresów itp.
- Publikowanie materiału. Z jaka dokładnością publikujemy (ograniczone jest to także wymogami redakcyjnymi), czy przedstawiamy dane podstawowe czy tylko syntetyczne zestawienia. Czy i w jakim stopniu można odtworzyć potrzebne dane z innych publikacji. Jakie powinniśmy przyjąć standardy w tej materii?
Jako materiały do dyskusji w formie pisanej przedstawiam kilka różnych formuł statystycznych. Z pewnością część błędów, które łatwo wyeliminować, wynika z odmiennego odczytania tych samych formuł statystycznych!
Dominację w naszym zespole wyliczamy ze wzoru:
![]()
| gdzie: | Di - dominacja i-tego gatunku, n - liczebność i-tego gatunku, N - łączna liczebność wszystkich gatunków |
Klasy dominacji przyjęlismy za Biesiadką i Kowalikiem gdzie (dostosowane do bezkręgowców wodnych i ich liczebności):
- Eudominanci - liczebność pow. 10%
- Dominanci - 5,01-10%,
- Subdominanci - 2,01-5%
- Recedenci - poniżej 2%
Frekwencję na stanowiskach (ewentualnie w innym zbiorze, układzie) wyliczamy ze wzoru:
![]()
| gdzie: | Fi - frekwencja i-tego gatunku, s - liczba stanowisk z i-tym gatunkiem, S - liczba wszystkich stanowisk |
Frekwencja na stanowiskach - pospolitość, frekwencja w różnych typach wód (siedlisk) - szerokość preferencji siedliskowych (walencja ekologiczna?)
Wskaźnik znaczenia ekologicznego:
![]() oraz w ujęciu procentowym
oraz w ujęciu procentowym ![]()
gdzie: D - dominacja, F - frekwencja.
Podobieństwa faunistyczne wyliczano wg znanej formuły Jaccarda:
![]() ...
...
| gdzie: | Pxy - podobieństwo faunistyczne
między dwoma układami (np. stanowiskami) x i y, c - liczba wspólnych gatunków dla x i y, a - liczba gatunków w zbiorze x, b - liczba gatunków w zbiorze y (a + b - c = n). |
Podobieństwa faunistyczne wg formuły Sorensena:
![]() dokładnie to samo co:
dokładnie to samo co: ![]()
różnica wynika z odmiennie przyjętych oznaczeń (a ta z wygody w zastosowanym algorytmie wykonywania obliczeń...)!
|
OTUi (układ X)
|
|||
| Wartość cechy |
1
|
0
|
|
|
1
|
a
|
b
|
|
|
OTUj (układ Y)
|
0
|
c
|
d
|
n = a + b + c + d, czasem traktowane jest jak n' = a + b + c
ujęcie tradycyjne tabelkowe stosowane od dawna w Katedrze Ekologii i Ochrony Środowiska, wynika ze sposobu zliczania danych w tabelce
|
Zbiór X
|
Część wspólna
|
Zbiór Y
|
|
Gatunki (3) b
|
Gatunki (4) a
|
Gatunki (7) c
|
|
W zbiorze X obecnych jest 7 gatunków (a)
|
|
|
|
W zbiorze Y obecnych jest 11 gatunków (b)
|
||
|
Wspólnych jest 4 gatunki (c)
|
||
Podobieństwa faunistyczne wg zmodyfikowanej formuły Sorensena, znanej
jako formuła Bray-Curtisa (wykorzystywane w programie Biodiversity);
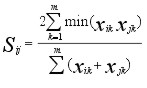
Podobieństwa faunistyczne wg formuły Biesiadki (formuła Jaccarda zwaloryzowana o liczebności larw):
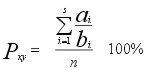
| gdzie: |
Pxy - podobieństwo faunistyczne między dwoma układami (stanowiskami,
zbiornikami itp.) x i y, |
Podobieństwa faunistyczne wg formuły Jaccarda, zwaloryzowanej o wskaźnik znaczenia ekologicznego (Czachorowski 1998):
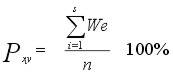
| gdzie: |
Pxy - podobieństwo faunistyczne między dwoma układami (stanowiskami,
zbiornikami itp.) x i y, |
Propozycje modyfikacji Lecha Pietrzaka:
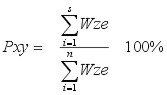
| gdzie: |
Pxy - podobieństwo faunistyczne między dwoma układami (stanowiskami,
zbiornikami itp.) x i y, |
- Formuła pokazuje na ile podobna, pod względem Wze, jest fauna obu układów. Liczy się, czy wartości współczynników są takie same, podobne mogą być więc do siebie zarówno dwa zbiorniki naturalne, jak i dwa zde-gradowane.
- W wynikach nie widać jak duży jest wskaźnik naturalności. Można wywnioskować jedynie czy jest on podobny w porównywanych zbiornikach czy nie, natomiast nie wiemy nic o jego wartości.
- Znaczenie mają również gatunki występujące tylko w jednym układzie, jeżeli mają wysoki Wze, to zmniejszają wartość wskaźnika, ale jeżeli maja niskie Wze, to ich znaczenie jest znacznie mniejsze (jest to dość poważna wada, ale można to potraktować także jako zaletę, moim zdaniem)
- Wartość wskaźnika 0 - 100 %.
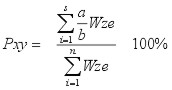
| gdzie: |
Pxy - podobieństwo faunistyczne między dwoma układami (stanowiskami,
zbiornikami itp.) x i y, |
Wskaźnik naturalności Fischera:

a - liczebność i-tego gatunku(1= bardzo rzadki, 5 = bardzo liczny), pozostałe jak niżej.
Wns - wskaźnik naturalności biocenoz w ujęciu jakościowym obliczano ze wzoru:
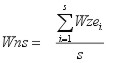
| gdzie: |
Wns - wskaźnika naturalności danej biocenozy, |
Wni - wskaźnik naturalności biocenoz w ujęciu ilościowym obliczano ze wzoru:
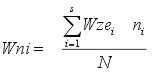
| gdzie: |
Wni - wskaźnika naturalności danej biocenozy, |
Dyskusję z warsztatów będziemy kontynuowali już w zaciszu gabinetów. Zapraszam do przyłączenia się:
dr hab. Stanisław
Czachorowski prof. UWM
Katedra Ekologii i Ochrony Środowiska UWM w Olsztynie
10-561 Olsztyn, ul. Żołnierska 14,
e-mail: stacz@matman.uwm.edu.pl
Ach te Halesusy...
Nie lubię oznaczać materiałów, w których jest dużo larw z rodzaju Halesus.
Szybko upewniam się, że jest to ten rodzaj, ale który gatunek? Odpowiedź
na to pytanie sprawia mi wiele problemów, kosztuje wiele czasu a często
jest nie możliwa. Stąd pomysł by zebrać w jednym miejscu cechy taksonomiczne
kłopotliwych gatunków.
W Polsce stwierdzono występowanie czterech gatunków z rodzaju Halesus:
H. digitatus, H. radiatus, H. rubricollis i H. tesselatus.
Halesus rubricollis jest chyba najłatwiejszy do rozróżnienia. Według klucza
Waringera i Grafa (1997) osobniki tego gatunku, w odróżnieniu od pozostałych
gatunków, posiadają tylko jedną szczecinkę na proksymalnej części dorsalnej
krawędzi uda III pary odnóży (patrz rys.). Skleryty i puszka głowowa H.
rubricollis mają żółte zabarwienie (u Chaetopteryx brązowe). Domek zbudowany
jest z detrytusu i fragmentów roślin.
Odróżnienie Halesus radiatus od H. tesselatus i H. digitatus, również
nie powinno sprawić nam problemu. Linia naboczna u H. radiatus występuje
na ok. 1/3 II segmentu odwłoka, natomiast u dwóch pozostałych gatunków
linia naboczna zaczyna się od III segmentu. Na pronotum H. radiatus ciemniej
ubarwiona jest tylko poprzeczna bruzda, u dwóch pozostałych gatunków na
pronotum występuje ciemny, trójkątny w zarysie kontur (Waringer i Graf
1997). Według Wallace'a (1990) w anteriolateralnej części głowy H. radiatus
znajduje się jasne pole (rys.), natomiast obie krawędzie tylnej części
frontoclypeusa oddalają się od środkowej linii w kierunku przedniej części,
dlatego część ta jest najszersza przed szczecinami ps. U H. digitatus
krawędzie te zbliżają się do linii środkowej i największa szerokość tej
części występuje na poziomie szczecin ps (rys.). Powierzchnia domku H.
radiatus jest nierówna, chropowata (Wallace 1990).
Najwięcej problemów z oznaczeniem sprawiają H. digitatus i H. tesselatus.
Według klucza Waringera i Grafa (1997) "najłatwiej"odróżnić
je chyba po układzie szczecin i alweoli na przedniej krawędzi frontoclypeusa.
U H. digitatus tworzą one linię prostą (rys.), natomiast u H. tesselatus
tworzą linię łamaną (rys.). Dodatkową cechą może być występowanie szczecin
na wentralnej stronie mezopleurytu u H. tesselatus, jednak nigdy nie wi-działem
tej cechy.
Według Lepniewej (1996) H. digitatus nie posiada bocznych skrzelotchawek
na II segmencie odwłoka lub są one nie w pełni wykształcone. Jednak przydatność
tej cechy jest wątpliwa, bowiem nigdy czegoś podobnego nie zaobserwowałem.
Oznaczenia larw H. digitatus i H. tesselatus chyba nigdy nie są stuprocentowo
pewne. Moim zdaniem, układ szczecin na frontoclypeusie jest cechą postrzeganą
subiektywnie, podobnie jak pozycja "spalonego" w piłce nożnej.
Często wydaje mi się, że z jednej strony wszystkie punkty tworzą linię
prostą, natomiast z drugiej linię łamaną. Dodatkowo prof. S. Czachorowski
zwraca uwagę, że cecha ta może ulegać zmienności osobniczej. Mam więc
apel do bardziej doświadczonych badaczy. Jak rozróżniać te gatunki? Może
ktoś zna lub zaobserwował cechy nie zapisane w kluczach?
Lech Pietrzak
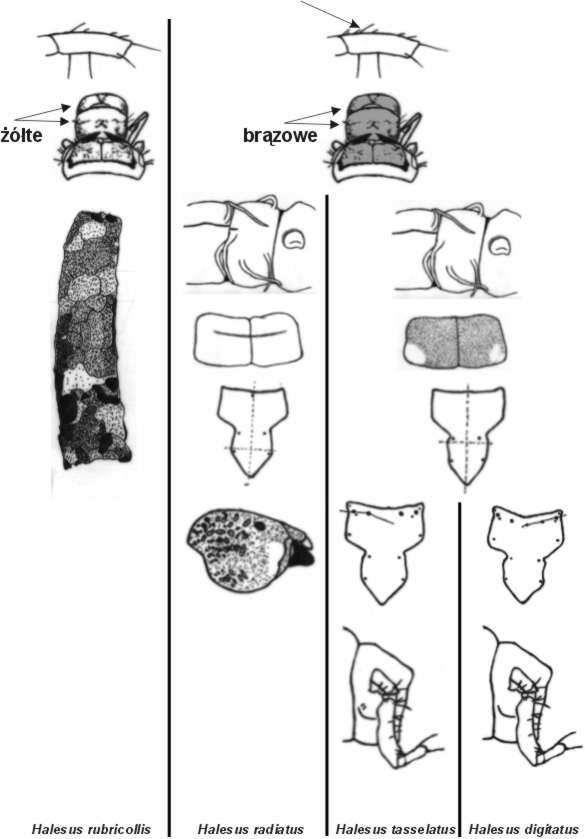
Rys. Schematyczne rysunki cech taksonomicznych występujących w Polsce larw z rodzaju Halesus (na podstawie: J. Waringer, W. Graf "Atlas der Österreichischen Köcherfliegenlarven" 1997 oraz I. D. Wallace, B. Wallace, G.N. Philipson "A key to the case-bearing caddis larvae of Britain and Ireland" 1990).
Redakcja
|
Kolegium redakcyjne w składzie: |
Adres redakcji: |
Biuletyn wydają: Polskie Towarzystwo Entomologiczne
Katedra Ekologii i Ochrony Środowiska Uniwersytetu Warmińsko Mazurskiego
